伴随着我国医疗卫生事业高速发展的趋势,为保障患者医疗安全与健康,医疗监管也在不断完善与加强,医疗器械唯一标识UDI就是在此背景下诞生,成为医疗器械监管手段创新和监管效能提升的重要抓手,助力医疗器械产业高质量发展。
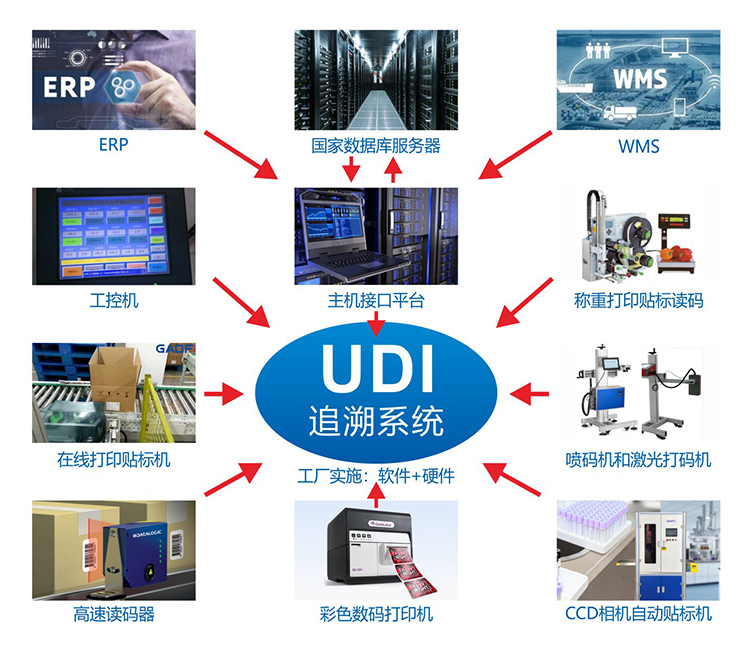
2023年是医疗器械唯一标识UDI实施的关键之年,为了方便各方进一步加强医疗器械唯一标识建设工作,高赋码在这里为大家汇总了UDI国家层面的政策相关的标准条目!
国家性政策
(1) 2012年1月
《国家药品安全“十二五”规划》
文件旨在建立健全医疗器械监管信息系统,启动高风险医疗器械国家统一编码工作。
(2) 2017年2月
《“十三五”国家药品安全规划》
文件制定了医疗器械编码规则,构建医疗器械编码体系。
(3) 2019年5月
《深化医药卫生体制改革2019年重点工作任务》
文件旨在建立健全医疗器械监管信息系统,启动高风险医疗器械国家统一编码工作。
(4) 2019年7月
《医疗器械唯一标识系统试点工作方案》
文件表明开展医疗器械唯一标识系统试点工作。
(5) 2019年8月
《医疗器械唯一标识系统规则》
文件规范了医疗器械唯一标识系统建设,明确医疗器械唯一标识系统建设的目的、适用对象、建设原则、各方职责和有关要求。
(6) 2020年7月
《深化医药卫生体制改革2020年下半年重点工作任务》
文件选取部分高值医用耗材等重点品种实施医疗器械唯一标识。
(7) 2020年9月
《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》
文件表明全面启动第一批唯一标识实施工作。
(8) 2021年2月
《医疗器械监督管理条例》
国家根据医疗器械产品类别,分步实施医疗器械唯一标识制度,实现医疗器械可追溯。
(9) 2021年9月
《国家药监局 国家卫生健康委 国家医保局关于做好第二批实施医疗器械唯一标识工作的公告》
开启第二批唯一标识实施工作,实施范围覆盖第三类医疗器械。
(10) 2022年3月
《医疗器械生产监督管理办法》
文件中规定了未按照国家要求实施医疗器械唯一标识的处罚措施。
(11)2022年3月
《医疗器械经营监督管理办法》
文件表明全面启动第一批唯一标识实施工作。
(12) 2022年5月
《深化医药卫生体制改革2022年重点工作任务》
文件中标明要分类推进医疗器械唯一标识实施工作,深化唯一标识在监管、医疗、医保等领域的衔接应用。
(13) 2022年6月
《医疗器械经营质量管理规范附录:第三方物流质量管理(征求意见稿)》意见
文件规定了医疗器械第三方物流企业应具有基于医疗器械唯一标识实现医疗器械运输、贮存服务全过程可追溯的计算机信息平台,建立并运行覆盖运输、贮存服务全过程的质量管理体系,确保医疗器械产品在受托贮存、运输过程中的质量安全和可追溯的要求。
(14) 2022年8月
《医疗器械唯一标识的创建和赋予》
文件针对唯一标识创建、赋予两个环节,对相关方的实施和应用提出了具体要求,是对相关法规的有益补充。
(15) 2022年11月
《医疗器械经营质量管理规范附录:专门提供医疗器械运输贮存服务的企业质量管理》
文件规定了专门提供医疗器械运输贮存服务的企业经营质量管理规范中唯一标识的要求。
(16) 2023年2月
《国家药监局 国家卫生健康委 国家医保局关于做好第三批实施医疗器械唯一标识工作的公告》
开启了第三批唯一标识实施工作,实施范围覆盖15大类103种的二类医疗器械。



