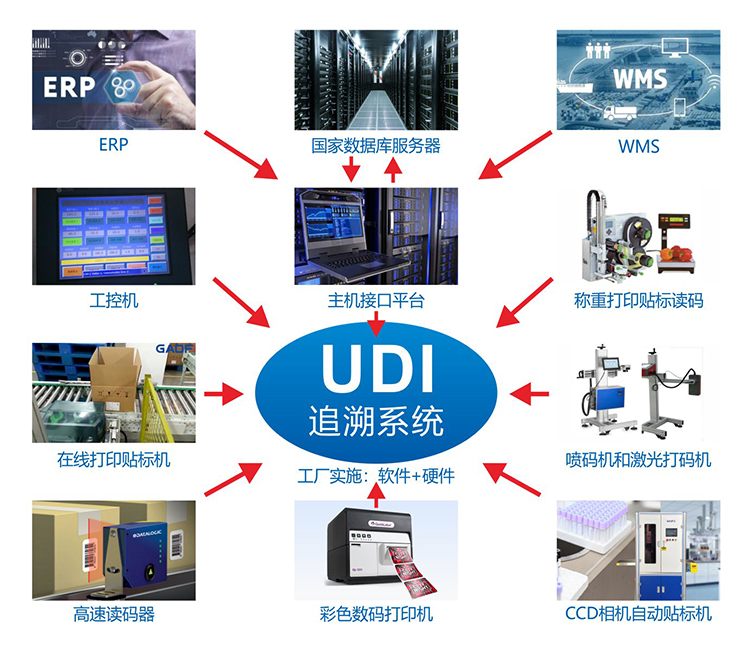
抗原检测试剂盒类产品在实施UDI过程中,主要有以下步骤:
第一步:申请厂商识别代码
GS1是国内唯一能够同时符合美国食品和药物管理局(FDA)、欧盟委员会和中国药品监督管理局(NMPA)三大机构的要求的码制。如果企业需要兼顾出口需求,GS1是更为方便的选择。申请厂商识别代码这一步骤可在在中国物品编码中心网上业务大厅完成。
第二步:申请UDI-DI
将生产企业所有需要赋UDI-DI 的产品的信息录入到UDI平台系统,则由系统生成该产品对应的DI编码。
第三步:UDI 数据库录入
登陆国家药品监督管理局医疗器械唯一标识数据库 ,根据数据库系统操作提示,进行用户注册、登陆,完成产品信息(包括第二步申请的UDI-DI)录入即可。生产企业使用UDI服务平台后,在完成DI编码后,可一键完成药监局数据库备案,及通报中国商品信息服务平台,保障企业产品在市场上顺畅流通。
第四步:编制UDI-PI
UDI-PI即生产标识,是动态的标识,是在医疗器械生产过程中产生的,用于每批特定的产品。对于IVD 类产品来说,PI至少应包含批号和有效期。
需要注意的是,如果抗原试剂盒包含多个组分,UDI通常是是赋在最小销售单元的外包装盒上,那么UDI通常是以最小销售单元的整盒需要一个单独的UDI码。
如果组分是可以单独出售的,那该组分是需要单独的UDI。
各级包装的UDI应该是全球唯一的。每个最小销售单元都应该有自己的UDI,每个盒子(内含若干个单元)、每个箱子(内含若干个盒子)也该有自己的UDI。
第五步:选择UDI 载体
目前几种常用的UDI载体有一维码、二维码和射频标签,企业可根据自身和产品的实际情况,结合产品风险和监管追溯要求选择合适的载体,用于UDI赋码即可。
第六步:赋码
根据上一步,企业选择的UDI载体,这时候还需要结合产品包装进行选择赋码的设备,UDI通常是是赋在最小销售单元的外包装盒上,使用标签打印或者直接喷码的形式都是可以的,企业可根据实际选择赋码设备。
第七步 代码验证
每个发行准则都要求证明条码具有“C”或更高的质量等级。这是为了确保所有条码都能被所有条码扫描仪读取。(参考文章:UDI合规 | 医疗器械唯一标识标签要质量合规,有哪些方面的具体要求?)为条码定级的唯一方法是使用条码验证器。验证器根据ISO标准对条码进行分级,并且验证器生成的报告可以打印或导出供将来参考。
这个环节其实非常重要。一些生产企业将UDI标签打印出来后就直接贴到产品包装上了,这具有很大风险性。许多不合格标签,人眼无法辨别合格性,若流入市场很可能让下游的经营企业和医疗机构无法识读,就只能召回并造成损失。为避免出现此种情况,产品出厂前,建议先进行标签检测。
赋码设备需要根据公司实际情况选择,最好是带有自动识别纠错系统的,这样能够保证打印出来的UDI码是可以被识别的。因此生产企业可以选购能实现自动校验的赋码设备。如果对产线效率有较高要求,可以选择定制带有识别纠错功能的生产线,这些可以联系慧铭佳团队协助实现。