医疗器械唯一标识(uniquedeviceidentifier,简称UDI)是医疗器械唯一性识别码,是准确采集医疗器械全生命周期数据的基础,是解决医疗器械监管问题的全球通用语言。
国际医疗器械监管机构论坛(IMDRF)于2013年发布了《医疗器械唯一标识系统指南》,在2019年又发布了一系列与UDI应用相关的文件,为计划建立UDI系统的监管部门提供全球互认的UDI实施建议,拉开了全球实施UDI的序幕。
美国、欧盟、沙特、阿根廷、日本、韩国等国家和地区均发布了UDI相关法规和指导性文件,联合国开发署在援助非洲的医疗项目中要求所有供应商实施UDI。
我国自2013年加入IMDRF后,稳步推进UDI实施,国家药品监督管理局(NMPA)也于2019年8月正式发布了《医疗器械唯一标识系统规则》。
GS1编码体系作为全球最广泛使用的物品编码标准,符合目前所有已实施UDI的地区的要求。早在2005年,中国物品编码中心(以下简称编码中心)就开始了GS1标准在医疗器械追溯监管中的研究工作。2007年,上海部分医院与几百家企业通过GS1标准进行器械唯一编码标识与追溯工作,有着较好的应用基础。
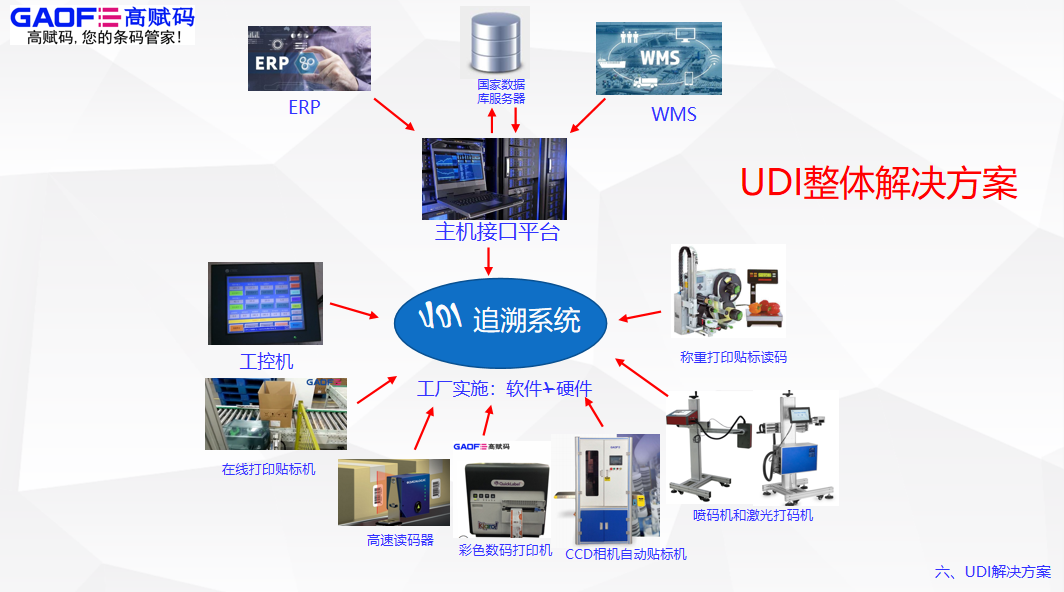
2019年,编码中心也成为了国家药品监督管理局认可的发码机构。企业采用GS1标准实施UDI大致可分为以下四个步骤:·申请成为GS1系统成员·根据GS1标准进行编码·将产品标识(DI)数据上传至药监备案平台·印制UDI标识申请成为GS1系统成员国家药监局发布的《医疗器械唯一标识系统规则》中明确指出器械注册人/备案人负责创建和维护医疗器械唯一标识。
因此,器械注册人/备案人可与所在地的编码中心分支机构取得联系,申请注册成为GS1系统成员,取得《商品条码系统成员证书》,获得厂商识别代码。



