目前UDI正不断推进落实中,面对一些医疗器械企业还不熟悉UDI的申请、操作流程的情况,作出以下展示:
首先是企业自检、组建UDI团队,寻找负责法规注册的人员实时跟进UDI相关法规发布情况让企业及时跟上政策作出相应行动;UDI的实行很大程度是利用了当下人工智能大数据的发展,需要有IT信息的相关负责人建立数据库,以保障数据安全有序录入调出;此外还需有研发人员进行相关内容的研发,推动企业创新发展,以及生产负责人员,质量监控员、销售人员、负责把控供应链与物流的人员和进行营运管理的人员。有了一个强大的团队,UDI的实施之路才可能畅通、行稳致远。如果一时间找不到相关人才也没关系,可以找高赋码,进行询问,提供专业指导。
接着就是选择适合自家产品的发码机构,目前市面上手药监局认证的机构有GS1、MA、AHM三家,在选择完发码机构后就需要进行UDI的申报,首先是DI的注册申请,比较常见的申报流程是在发码平台完成注册缴费得到DI编码,之后企业根据编码规则进行编码和校验再登录药监局平台填写产品信息,将DI编码上报药监局平台,药监局数据库就会审核所有DI数据并公布申报情况,也可以让高赋码协助申请。
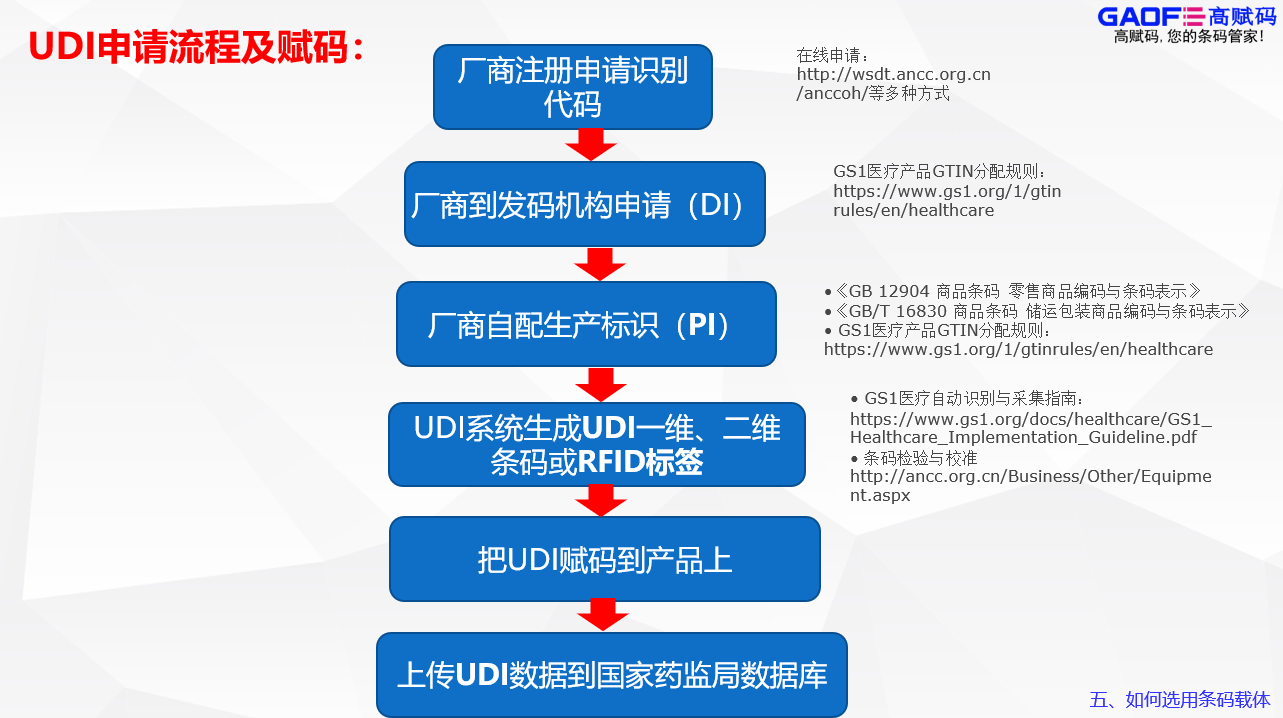
在审核通过后,就要开始进行标签设计,通过软件生成相应的数据载体后将其赋码到产品上,如果使用的是RFID,则必须同时附带一维码或二维码标签,标签上除了要有码图还要有中文标示说明,标签的印刷质量需符合ISO15415标准的C级以上,同时UDI的编码与码图内容要保持一致性,一码一图,UDI还需符合AIDC与HRI原则。而不同的赋码设备,其所需要的软件也不同,操作模式也不相同。



