企业实施UDI需要考虑哪些风险?
日期:2022-01-03 来源: 点击:
合理估算UDI实施时间
“根据最新要求,产品申请首次注册、延续或变更注册时,申请人或注册人应当在注册管理系统中提交其最小销售单元的产品标识(UDI-DI)。未按要求在申请表中填写UDI-DI的,申请表无法提交,注册申报资料不予签收。”
UDI由政策强制推动,各省市均有时间要求,尤其在全域试点的区域,产品注册备案必须要具备UDI。
同时,由于不同企业产品数量、规格、型号、包装均有不同,实施UDI所需时间长短也不尽相同。如果因为产品较多,实施UDI周期过长,当国家及各省市正式推进UDI时,留给企业时间不足,无法及时完成相关工作,将导致企业产品无法如期上市销售。
UDI编码规范细节问题
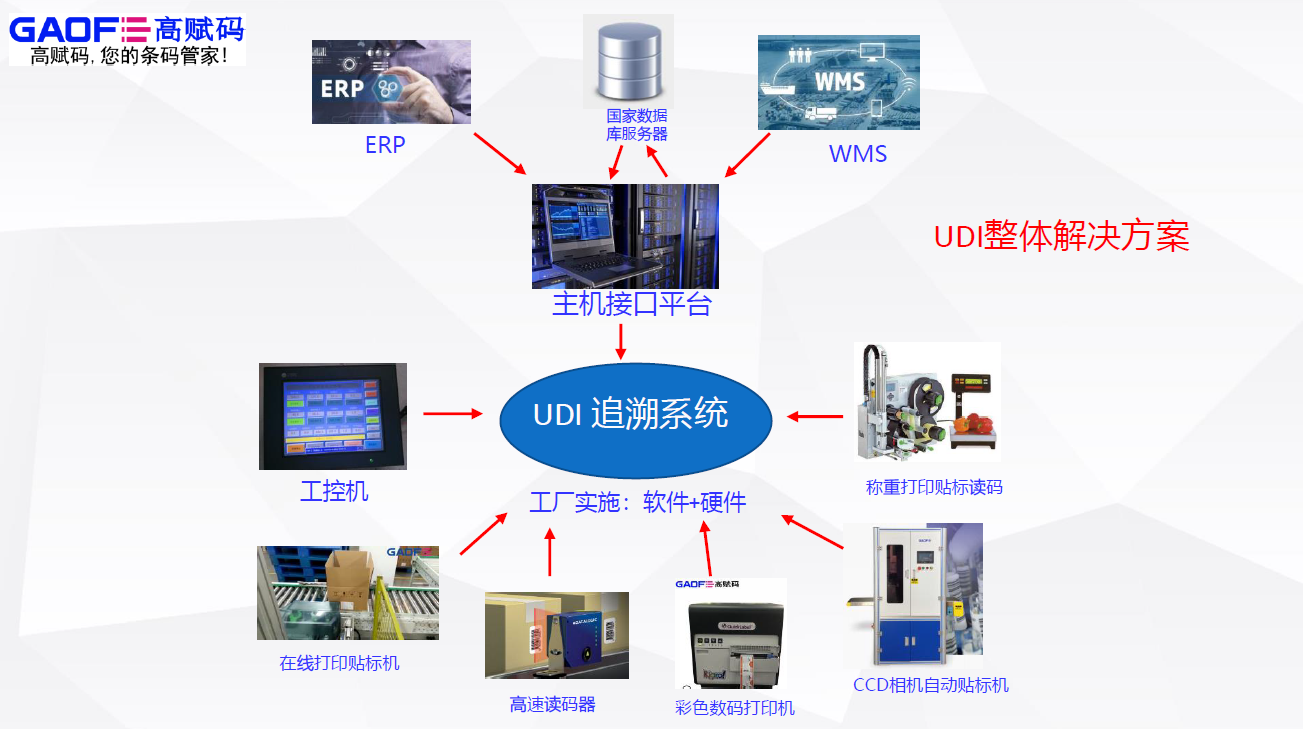
当前,在我国UDI仍属于新兴领域,目前市场上仅有48%的医疗器械存在编码,众多企业实施产品编码赋码没有软件或设备支撑,企业在具体实施过程中经常面临许多具体问题。如果没有正确理解UDI相关政策,不了解UDI实施编码规范就盲目进行UDI实施,将导致细节实施不规范,存在较大的运营风险。
例如:最小包装问题?包装层级问题?IVD编码问题?PI编码及管理问题?独立软件贴标问题?
质量藏在细节之中,任何一个细小问题都可能导致编码错误,影响产品销售,增加经营风险。
数据管理安全问题
当前,许多企业在实施UDI时,并未部署UDI数据库,而仅仅使用Excel表来保存和管理相关数据。一方面若采用excel表格来管理UDI相关数据,容易造成数据遗失和错误,数据管理成本较高。另一方面,后期需要重新调用相关数据时,要花费大量时间来寻找数据源文件,不符合国家相关规范。
提前预估试错风险与可能出现的连锁问题
UDI与企业生产直接挂钩,如果编码、识读出问题将导致企业产品整批返厂。
在实际生产过程中,不同生产线、不同产品需要对应不同的赋码设备。医疗器械赋码方式主要有高解析喷码、可变数据印刷、热转印、贴标、激光打标以及条码打印方式等。
由于产品通常是多层级包装,不同包装之间涉及的赋码技术可能也不相同,所以在针对UDI搭建赋码设备时,需要对产品和产线情况比较了解,才能避免因设备与场景选择不当导致赋码不合规,或者降低产线生产效率。
医疗器械产品事关民生安全,在“十三·五”规划中被列为“需尽快推动追溯体系落地”的“重要物品”。为了创造规范健康的市场环境,国家颁布了一系列UDI实施工作准则,对UDI的实施提出了高质量高水平的严格要求。于企业而言,提前梳理清楚相关问题是最基础的准备工作,才能避免走弯路,高效完成UDI实施。